代谢和免疫途径受到多种机制的严格调控和交织,以控制代谢健康。这些途径的失调是肥胖和 2 型糖尿病 (T2D) 等代谢疾病发展的根本原因,这些疾病近年来在世界范围内盛行。迄今为止,代谢和免疫途径相互作用的分子机制尚未完全了解。陈帅和王红宇与实验室成员王奇和荣平一起,试图确定相互作用的机制。
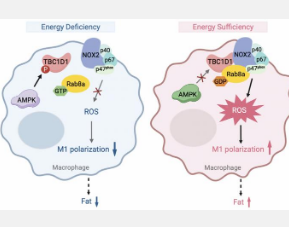
AMP 活化蛋白激酶 (AMPK) 是一种重要的能量传感器,能够对能量状态作出反应以维持代谢稳态。能量状态与巨噬细胞中活性氧 (ROS) 的产生有关,肥胖患者中活性氧水平升高。然而,尚不清楚巨噬细胞中能量充足时 ROS 产生如何上调。
Rab-GTPase活化蛋白(RabGAP)TBC1D1是AMPK的底物。前期研究表明,AMPK激酶能够调控TBC1D1蛋白上丝氨酸-231的磷酸化,从而改变其GAP活性。TBC1D1 S231A突变可以诱发假能量充足信号。课题组发现,TBC1D1 S231A突变可导致小鼠肥胖、高血糖、胰岛素抵抗、高脂血症、非酒精性脂肪肝等代谢性疾病。在此,研究团队发现TBC1D1 S231A小鼠的骨髓来源的巨噬细胞(BMDM)和脂肪组织巨噬细胞中的ROS水平明显高于野生型小鼠。此外,TBC1D1 S231A小鼠的巨噬细胞表现出M1型(经典活化)巨噬细胞极化。相反,与 WT 对照相比,TBC1D1 基因敲除 (KO) 小鼠的骨髓巨噬细胞和脂肪组织巨噬细胞中的 ROS 水平显著降低。TBC1D1-KO 小鼠的巨噬细胞表现出 M2 型(替代激活)巨噬细胞极化。为了确定 TBC1D1 在巨噬细胞中对肥胖的作用,该团队进行了骨髓移植实验。将 TBC1D1 S231A小鼠的骨髓移植到野生型小鼠体内,受体小鼠患上了肥胖症。这些数据表明,TBC1D1 是巨噬细胞中活性氧产生和炎症状态的关键调节剂,可促进肥胖。
随后,该团队研究了 TBC1D1 如何调节巨噬细胞中的 ROS 生成。他们发现 TBC1D1 调节小 G 蛋白 Rab8a 来控制巨噬细胞中的 ROS 生成。GDP 结合形式的 Rab8a 增加了细胞中的 ROS 生成。骨髓特异性 Rab8a 基因敲除小鼠体重较轻,M1 极化减少。从机制上讲,GDP 结合的 Rab8a 与巨噬细胞中的 NADPH 氧化酶 NOX2 相互作用以促进 ROS 生成。这些数据表明,TBC1D1 S231A突变可能通过增加 GDP 结合的 Rab8a 来增加 ROS 生成,从而引发炎症。
为了进一步验证ROS在TBC1D1 S231A小鼠肥胖进展中的作用,研究团队利用ROS清除剂TtSOD通过肠道进入体内,特异性地靶向脂肪组织中的巨噬细胞。TtSOD治疗减轻了TBC1D1 S231A小鼠的肥胖和脂肪组织炎症,也改善了高血糖、高胰岛素血症、高胆固醇血症和胰岛素抵抗等代谢性疾病。此外,TtSOD治疗还可以缓解饮食引起的肥胖和相关的代谢紊乱,如高血糖、高胆固醇血症和胰岛素抵抗。
总之,这项研究阐明了一种控制巨噬细胞响应能量超载而产生 ROS 的新型调控机制,其中 TBC1D1 及其下游靶标 Rab8a 与 NOX2 形成能量响应复合物,以控制 ROS 产生和随之而来的炎症。这些发现对于研发对抗肥胖的药物具有重要意义。
免责声明:本文由用户上传,如有侵权请联系删除!