解锁LNPmRNA的治疗适用性化学配方和临床策略
mRNA疗法最近已成为各种临床疾病治疗领域的一个突出领域。早在 1978 年,mRNA 就已被用作遗传物质通过脂质体递送至细胞以诱导蛋白质表达[1]。自辉瑞-BioNTech 和 Moderna 两种脂质纳米颗粒-mRNA 疫苗在抗击 covid-19 大流行方面取得显著成功以来,这种方法已成为人们关注的焦点。由于 mRNA 的不稳定性,脂质纳米颗粒在实现 mRNA 效应方面不可或缺的作用引起了科学家的关注。迄今为止,由胆固醇、磷酸脂质和聚乙二醇化脂质组成的脂质纳米颗粒 (LNP) 是临床上最先进的非瓶装 mRNA 递送平台。LNP 因其能够封装和保护 mRNA 分子免于降解,同时促进其递送到靶细胞中而引起了广泛关注。然而,尽管LNP mRNA 疗法前景光明,但要成功实现临床转化仍面临诸多挑战,例如:1. 特异性靶向非肌肉和非肝细胞;2. 扩大 LNP 规模时的质量控制;3. 安全问题
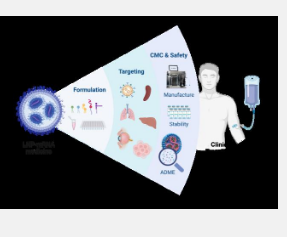
研究进展
LNP 作为一种新型药物输送系统,其增强 mRNA 治疗效果的输送能力已被证实。本综述对当前基于 LNP mRNA 的疗法的最新进展提供了宝贵的见解,并强调了将 mRNA 转化为临床治疗方面仍未满足的需求。这些包括优化 mRNA 疗法的剂量、满足化学、制造和控制 (CMC) 要求、确保安全性以及提高靶向效率以改善治疗结果(图 1)。
首先,作者对近十年来已发表的可电离脂质、胆固醇、磷脂和聚乙二醇化脂质进行了阐述和分类。可电离脂质的设计和合成原理遵循正电荷头部(通常包含胺、胍和杂环基团)、连接子和疏水脂质尾的组合(图2)
高通量合成可电离脂质是一种实现新型高效可电离脂质设计和筛选的化学方法。例如,Anderson博士和Langer团队利用两种可电离脂质A2-Iso5-2DC18和A12-Iso5-2DC18发现了显著更高的细胞因子部分。通过从1080种可电离脂质中进行筛选,排名前两位的可电离脂质在癌症疫苗应用中显示出激活STING免疫介导途径的潜在能力(图3)。
胆固醇和磷脂 在LNP的形成和靶向性方面起着重要作用。最近,Whitehead博士的研究小组通过增加LNP中磷脂的含量,实现了器官特异性递送。他们将磷脂脂质的含量增加了10%至40%,以实现更高的脾脏靶向性。另一方面,他们还发现带负电荷的磷脂倾向于靶向脾脏,而带正电荷的辅助脂质倾向于靶向肺脏(图4)。
此外,科学家还通过改变LNP的净电荷实现了器官选择性靶向。例如,Siegwart博士的研究小组研究了添加第五种化合物,通过将LNP与18PA和DOTAP配制,实现了肝脏、脾脏和肺脏的选择性靶向(图5)。
除了阐明 LNP 在化学修饰过程中发展和形成的复杂性外,该综述还强调了通过表面修饰增强 LNP-mRNA 递送的替代策略。表面修饰的 LNP(例如包含聚乙二醇化脂质或配体介导的靶向部分的 LNP)已显示出改善循环时间、减少非特异性相互作用和增强细胞摄取的潜力(图 6)。
LNP在体内的清除和循环时间通常由PEG化脂质的含量和长度控制。PEG化LNP表面的策略已被广泛用于稳定纳米粒子并降低与血清蛋白的非特异性相互作用。然而,增加PEG的长度也会降低LNP与内体膜之间的融合,这被称为“PEG困境”。PEG屏蔽是影响LNP生物分布效率的另一个因素。改变PEG的长度和含量会影响生物分子的电晕吸附,从而影响LNP的治疗效率。
除了PEG化,在LNP表面结合配体或抗体是增加器官特异性靶向性的另一种策略。如图7所示,4%的T细胞可以通过LNP在体内转染,16%的CD3抗体结合在LNP表面。Rurik等人已经证实了抗体偶联的LNP的治疗效果。他们通过CD5抗体偶联的LNP在Cre-loxP报告小鼠中实现了81.1%的脾脏CD4 + T细胞和75.6%的脾脏CD8 + T细胞报告蛋白表达。并且扩展了他们的研究,将表达FAPCAR的mRNA递送到T细胞中以治疗心脏损伤和纤维化(图8)。
这些进步对于克服 LNP 介导的 mRNA 治疗中存在的挑战和推进这些创新治疗方法的临床转化具有巨大的潜力。
LNP-mRNA 在体内表现的另一个方面仍不清楚。注射后,纳米颗粒与蛋白质相互作用,形成电晕效应,将影响器官靶向性。不同的 LNP 会形成独特的蛋白质电晕,靶向不同的组织。例如,ApoE 有助于肝脏靶向,玻璃粘蛋白增强肿瘤细胞介导的递送,纤维蛋白原增强肺靶向性。电晕吸附与纳米载体涂层和动力学密切相关。在 LNP 中,PEG 长度和烷基链影响表面化学和电晕,从而影响组织靶向性(图 9)。
本文讨论了当前扩大 LNP 规模以满足制药行业商业化生产标准所面临的障碍。
储存:商业化的LNP-mRNA疫苗需要低温储存和冷链运输(-80°C),这在一定程度上限制了其广泛使用。因此,加入合适的冷冻保护剂并实现稳定的冻干或冷冻储存对于mRNA疗法的开发至关重要。
表征:普通实验室中的传统动态光散射 (DLS) 仪器无法满足药物生产对 LNP 大小、zeta 电位、多分散性指数 (PDI) 和包封率的严格标准。也没有精确的方法来评估空 LNP 的比例。研究报告了一种基于多激光圆柱照明共聚焦光谱 (CICS) 的方法,用于在单个纳米颗粒水平上检测 LNP 制剂中的 mRNA 和脂质含量,这可以为商业化生产提供范例(图 10)。
安全性:目前对LNPs在体内的吸收、分布、代谢和排泄(ADME)特性还缺乏深入研究,在mRNA治疗的临床转化中,需要更大剂量的LNP-mRNA药物,对生物安全性的要求更高。
尽管在临床前研究中取得了进展,但 LNP mRNA 疗法向临床实践的转变仍遇到了一些障碍。虽然 mRNA 疫苗在 COVID-19 等传染病中取得了成功,但它们在肿瘤学等其他治疗领域的应用在临床试验中遇到了挫折。例如,Moderna 用于治疗实体恶性肿瘤/淋巴瘤的 mRNA2752 在 I 期试验(NCT03739931)中终止,这凸显了需要进一步研究以解决临床转化的剩余障碍。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
