研究人员开发出精确靶向癌症病变同时保护健康组织的新方法
一组研究人员开发了一种新方法,可以抑制药物向健康组织的分布,同时也可以快速清除分布在体内的药物,这可以提高疑难癌症的影像诊断准确性,减少对健康组织的毒性,并进一步提高治疗效果,最近发表在《受控释放杂志》上的一项研究报告称。
放射性药物作为下一代癌症成像和癌症治疗药物一直备受关注。到目前为止,大多数研究都集中在开发将药物输送到癌症病灶的技术,但不可避免地将药物输送到健康组织。
由国家癌症中心探索性肿瘤学研究与临床试验中心功能诊断开发领域研究人员 Izumi Umeda 领导的研究小组,他当时也是 Kavli 宇宙物理与数学研究所 (Kavli IPMU) 的项目研究员和 Hirofumi Fujii 以及来自千叶大学、Kavli IPMU 和京都医科大学的研究人员,结合了核医学、药物输送系统 (DDS) 和复杂化学的成分,开发了一种控制放射性核素体内动力学的方法-行政。
该团队的方法允许放射性药物在癌症病灶中充分积聚,同时缩短药物与健康组织接触的时间。这意味着药物可以集中作用于癌症病灶,与传统方法相比,提高了对癌症病灶的治疗效果。
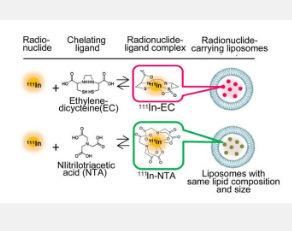
两种类型的放射性药物,或RI包封的脂质体(图1),具有相同的脂质体成分和粒径,并且RI相同111 In,仅配体不同。次氮基三乙酸(NTA)是一种典型的配体,而亚乙基二半胱氨酸(EC)是该团队实验中心的新配体。
将两种类型的111 In-配体脂质体给予患有肿瘤的小鼠,研究人员监测了癌症和健康组织,特别是肝脏和脾脏中111 In 的摄取和积累(图 2)。两只小鼠的肿瘤差异不大,但在肝脏和脾脏中,111In -EC-脂质体一旦被吸收,然后很快被清除,而传统的111In -NTA-脂质体则保留很长时间。111 In-EC-脂质体还促进排泄到粪便中,尿液中的化学形式是111 In-EC,而不是脂质体中的。
研究小组发现,在肝脏中,脂质体被分解,释放出内部的111 In-配体复合物,而在肿瘤中,脂质体长期保持完整,111 In-配体复合物仍保留在脂质体中。独特的复合物111 In-EC 在从脂质体释放后可以从肝脏快速清除。
在荷瘤小鼠给予111 In-EC-或111 In-NTA-脂质体后的体内SPECT/CT图像中(图3),两种脂质体在体内的分布一开始就几乎相同。然而,后来,由于来自肝脏和脾脏的信号可以忽略不计,111 In-EC-脂质体清晰地出现在肿瘤部位,而111 In-NTA-脂质体由于与上述器官的清除率低而无法选择性地对肿瘤进行成像。这些图像与上述生物分布研究一致。
根据这项研究的结果,该团队提出了一个方案来解释携带放射性核素的脂质体的体内命运(图4)。静脉注射后,传统的111 In-NTA-脂质体和新型111 In-EC-脂质体在血流中循环,并在肿瘤中积累到相似的程度。大多数脂质体在肿瘤内长时间保持完整,因此,封装的放射性核素-配体复合物保留在脂质体内。此外,脂质体被肝脏吸收,并在肝脏中迅速降解并释放其封装的111 In-配体复合物。
从脂质体中释放后,传统的111 In-配体复合物,例如111 In-NTA,会在肝脏中保留很长时间。相比之下,111 In-EC 能够从肝脏中逸出,并以其原始形式迅速从尿液中排出。研究人员表示,快速尿液排泄而不在其他组织中积累将使放射性物质迅速从体内清除,并将损害降至最低。
“事实上,在考虑高精度癌症治疗或治疗诊断学将发挥的作用时,目前从新的角度开发了一种新的药物开发方法,以维持癌症病变中的药物浓度,同时保护健康组织,这一点非常重要在治疗疑难杂症时。未来,我们希望进一步的研究能够开发出只停留在癌症病变中的药物,这是以前从未做过的。”Umeda 说。
他们的研究细节发表在8 月 23 日的《Journal of Controlled Release》杂志上。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
